দ্রবণের মোলারিটি ও শতকরা হারের পারস্পরিক রূপান্তর
দ্রবণের মোলারিটি ও শতকরা হার (percentage by mass) একে অপরের সাথে সম্পর্কিত। এই সম্পর্কটি সাধারাণত কেমিস্ট্রি ও রাসায়নিক বিশ্লেষণে গুরুত্বপূর্ণ।
মোলারিটি একটি দ্রবণে দ্রবিত পদার্থের পরিমাণের পরিমাপ। এটি গ্যালন বা লিটার প্রতি মোল হিসাব করা হয়, এবং এর একক সাধারণত M (মোল/লিটার) থাকে।
এদিকে, শতকরা হার (percentage by mass) হলো দ্রবণে দ্রবিত পদার্থের ভর (mass) কে দ্রবণের মোট ভরের সাথে তুলনা করে শতকরা হিসাবে প্রকাশ করা।
রূপান্তরের সূত্র
মোলারিটি থেকে শতকরা হার রূপান্তর:

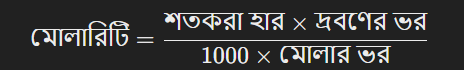
এখানে,
- মোলার ভর = দ্রবিত পদার্থের এক মোলের ভর (গ্রাম/মোল)
- দ্রবণের ভর = দ্রবিত পদার্থ ও দ্রাবক পদার্থের মোট ভর
শতকরা হার থেকে মোলারিটি রূপান্তর:
উদাহরণ:
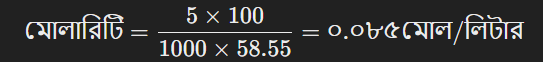
ধরা যাক, ১০০ গ্রাম দ্রবণে ৫ গ্রাম NaCl (সোডিয়াম ক্লোরাইড) দ্রবীভূত করা হয়েছে। NaCl এর মোলার ভর ৫৮.৫৫ গ্রাম/মোল।
প্রথমে, শতকরা হার বের করতে হবে:
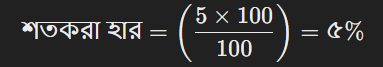
এখন, মোলারিটি বের করা:
এই রূপান্তরগুলি দ্রবণের মোলারিটি ও শতকরা হারের মধ্যে সম্পর্ক বুঝতে সাহায্য করে।
সারাংশ
মোলারিটি এবং শতকরা হারের মধ্যে সম্পর্ক সরল গাণিতিক সূত্রের মাধ্যমে রূপান্তরিত হতে পারে, যা রাসায়নিক গবেষণা এবং দৈনন্দিন জীবনে দ্রবণ তৈরি করতে ব্যবহৃত হয়।
Read more






